您现在的位置: 百济新特药房网首页 >> 药品专题 >> 多吉美|索拉非尼 >> 多吉美治疗肾癌
多吉美治疗肾癌的II期临床研究
- 来源: 研究者手册第六版 作者:百济动态 浏览: 发布时间:2007/7/30 11:53:00
初期的临床II期研究计划包括一项大宗的非连续性随机化研究(研究100391)。这项研究起初主要入选结直肠癌患者,同时入组部分晚期实体瘤患者。在初步结果显示出对肾癌可能有效后,这项研究的主要研究目标增加了肾癌。而且也进行了许多针对其它肿瘤的临床II期研究,以发现某些可能产生效果的特定瘤种。
研究中总计入组501例各种恶性肿瘤患者,其中有202例晚期RCC患者,32例既往未接受过任何治疗。这32例索拉非尼一线治疗的晚期RCC患者,无进展生存率50%,无进展生存时间为140天
单药研究
初步的II期研究发现了Sorafenib单药治疗可能对某些肿瘤临床有效的线索。因此进一步进行了2项II期研究(研究100391、10874),总结如下(见表5-2)。研究100391是一项非连续性随机研究,所有参加者先经过12周的诱导期,即给予Sorafenib 400mg每日两次口服。12周后,至少表现为轻度缓解的患者继续给予Sorafenib治疗,疾病进展的患者停止用药,疾病稳定的患者再随机分入安慰剂组或Sorafenib组进行治疗。此研究对象包括了各种晚期实体瘤,初步设计时主要针对结直肠癌,后来扩展到肾癌和其他肿瘤类型。研究10874是治疗肝细胞肝癌的开放性非对照研究。表5-2列出了已结束的单药II期研究。
表5-2:已结束的Sorafenib单药II期研究
|
研究编号 |
参加国家 |
肿瘤类型 |
安全性评价有效病例数 |
|
100391 |
美国、英国 |
晚期难治性实体瘤
(主要为结直肠癌、肾癌) |
501 |
|
10874 |
比利时、法国、以色列、意大利、美国 |
肝细胞肝癌 |
137 |
截止至2004年12月31日,还有4项Sorafenib单药II期研究正在进行中(包括研究11515、100555、100557、10941)。研究11515是在日本进行的单药治疗肾癌的II期研究。截止至2004年12月31日,有2例患者入组。研究100555是一项治疗转移性乳腺癌的多国(德国、意大利)开放性研究,共有54例患者接受治疗。研究100557是一项在美国和德国进行的治疗非小细胞肺癌的II期研究,截止至2004年12月31日,共有52例患者入组。研究10941是在美国和法国进行的一项治疗慢性粒细胞白血病(CML)的II期研究,截止至2004年12月31日共有10例患者接受治疗。表5-3列出了正在进行的单药II期研究。
表5-3:进行中的Sorafenib单药治疗的II期研究
|
研究编号 |
参加国家 |
肿瘤类型 |
治疗病例数(截止至2004年12月31日) |
|
11515 |
日本 |
肾癌 |
2 |
|
100555 |
德国、西班牙、意大利 |
乳腺癌 |
54 |
|
100557 |
美国、德国 |
非小细胞肺癌 |
52 |
|
10941 |
美国、法国 |
慢性粒细胞白血病 |
10 |
研究100391
研究100391的结果进一步证实了Sorafenib对治疗晚期肾癌患者有效。研究100391中的主要疗效指标是患者随机分组12周后的无进展生存率,即指随机分组后12+3周内疾病稳定或缓解的患者占总入组患者的百分比。如果患者随机分组后15周未进行肿瘤评估,则以下一次肿瘤评估的结果为准。但是如果一直未进行肿瘤评估的患者则认为是肿瘤进展。表5-10总结了随机分组后12周的无进展生存率。
表5-10:研究100391中肾癌患者随机分组后12周无进展生存情况总结
(分析人群:所有参加随机分组的肾癌患者)
|
统计学指标 |
Sorafenib组(共32例) |
安慰剂组(共33例) |
|
无进展生存人数 |
16 |
6 |
|
无进展生存率(%) |
50.0 |
18.2 |
|
95%置信区间(%) |
31.9-68.1 |
7.0-35.5 |
|
P值 |
0.0077 | |
随机分组12周后,分别有50%的Sorafenib组患者(16/32)和18%的安慰剂组患者(6/33)疾病无进展,两组比较结果有统计学差异(P=0.0077)。
28例安慰剂组患者出现疾病进展(中位疾病进展时间为7周)后改为服用Sorafenib治疗。这些患者改为Sorafenib治疗后至结束治疗的中位时间为24周,表明在改用Sorafenib治疗令病情在开始进展后重新得到控制。
研究者还分析了无进展生存时间,随机分组后安慰剂组患者的无进展生存时间为41天,Sorafenib组患者的无进展生存时间为163天,两组比较有统计学差异(P=0.0001)。治疗组患者的无进展生存Kaplan-Meier曲线见图5-5。
图5-5:研究100391中入组肾癌患者的无进展生存(天)Kaplan-Meier曲线
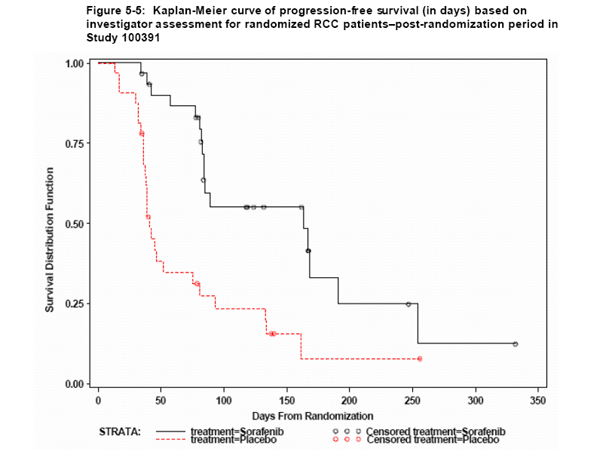

对所有肾癌患者(包括参加和未参加随机分组者)的无进展生存进行分析,由研究者判定的中位无进展生存时间为162天(95%置信区间为137-183天),而经独立专家组审核证实的无进展生存时间为140天 (95%置信区间为123-161天)。








