您现在的位置: 百济新特药房网首页 >> 药品专题 >> 多吉美|索拉非尼 >> 临床研究
多吉美的临床药代动力学研究
- 来源: 研究者手册第六版 作者:百济动态 浏览: 发布时间:2007/7/30 11:45:00
概述
此部分内容目的是提供对Sorafenib临床药理研究方案的总结。此节中提到的研究包括为确定用药剂量而进行的剂量递增型研究,生物药剂学研究,代谢途径的研究,对特殊人群的研究以及为评价Sorafenib与其他已上市的抗癌药物联用时的药效学及安全性研究,以上研究结果已于2004年12月31日报道。此节还增加了在日本进行的剂量递增型研究11497所得到的药代动力学资料(于2005年4月22日报道)。
在癌症患者中进行的I期研究目的是寻找适合的给药方案,以达到最长的给药间隔而不影响药物浓度,因此对多种给药方案进行了观察。从这些I期研究中得出的安全性和药代动力学以及药物抗癌效果的资料促使在后来开展的临床II期研究中采用400mg每日两次的连续给药方案。
Sorafenib的药代动力学结果显示暴露量在患者间存在较高差异,变异系数百分比(%CV)范围从36%到91%。与单剂量相比,口服400mg每日两次的稳态Cmax和 AUC(0-12)均值分别增加了4倍和4.7倍。与单剂量相比,口服400mg每日两次的稳态Cmax和 AUC(0-12)均值分别增加了4倍和4.7倍。进食高脂肪饮食后Sorafenib的吸收降低了约29%。因此,在服用Sorafenib时,应进食中等脂肪饮食或者禁食。Sorafenib与阿霉素联合用药,阿霉素在HCC患者的AUC均值增加了21%。尚不清楚这种相互作用是否具有临床相关性。
Sorafenib与依立替康联合用药,依立替康的活性代谢产物SN-38的暴露量显著增加(67%到120%),SN-38经由UGT1A1进行代谢。这种相互作用的临床相关性未明。
药物吸收
Sorafenib的药代动力学研究采用的方案包括健康研究者单次给药和癌症患者每日两次给药。在健康志愿者与中等量脂肪餐一起单次服用400mg后,Sorafenib吸收较快,中位达峰浓度时间tmax约4-8小时,平均最大浓度Cmax范围1.67-2.13mg/L。血浆浓度-时间资料显示出1-2个tmax后的再吸收峰,意味着其肝内再循环。稳态药代动力学对癌症患者服用Sorafenib片剂400mg每日两次后进行多点分析(研究100342、100277和10164的血浆药代动力学样本在第一疗程最后一次给药后收集)。Sorafenib的中位吸收时间tmax,ss为3小时(范围0.0-24小时),tmax后再吸收峰出现于给药后8-12小时或/和24小时。欧洲和北美进行的I期研究中患者平均稳态下Cmax,ss、AUC(0-12),SS值分别为7.7mg/L和64.3mg*hr/L。(见表5-7)
表 5-7:在试验10164、100277、100283和100342中,癌症患者口服给药,每日两次,每次服用400mg Sorafenib后,血浆中Sorafenib及其代谢产物的稳态Cmax和 AUC(0-12)参数(几何平均值,%CV)
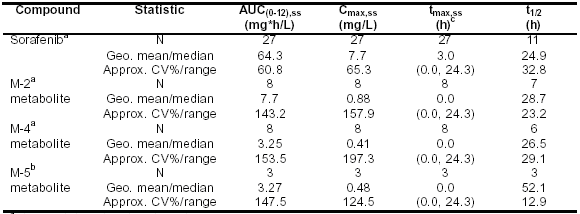

a 给药至少7天后的稳态数据
b 给药至少21天后的稳态数据
c tmax的平均值及范围
t1/2 半衰期,与血药浓度-时间曲线的末端斜率有关
Sorafenib的药代动力学结果显示暴露量在患者间存在较高差异,变异系数百分比(%CV)范围从36%到91%。
多剂量蓄积
I期临床试验评价了多剂量给药后Sorafenib在血液中的蓄积。虽然患者间存在相当大的差异,但是与预计的单一Sorafenib的终末端消除半衰期均值约为25到48小时的结果相符。比较试验10164中患者7天和21天的暴露量数据,发现给药7天之后Sorafenib的暴露量不再增加,因此Sorafenib的暴露量在给药后7天之内就达到了稳态。与单剂量相比,口服400mg每日两次的稳态Cmax和 AUC(0-12)均值分别增加了4倍和4.7倍。
相对生物利用度
通过与含有PEG和吐温-80的溶液剂对比,评价50mg Sorafenib片剂的相对生物利用度。与溶液剂相比,与单剂量相比,口服400mg每日两次的稳态Cmax和 AUC(0-12)均值分别增加了4倍和4.7倍。
膳食的影响
为了研究膳食的影响,分别评价了健康志愿者服用单剂量Sorafenib,同时进食高脂肪饮食、中等脂肪饮食或禁食状态下的药代动力学。进食中等脂肪饮食后Sorafenib片剂的生物利用度与禁食情况相似。与禁食相比,进食高脂肪饮食后Sorafenib的吸收降低了约29%。因此,在服用Sorafenib时,应进食中等脂肪饮食或者禁食。
每日一次与每日两次
分别评价了Sorafenib以两种方式给药的药代动力学:单剂量200mg(QD)和100mg每日两次(bid)。在服用100mg bid的患者,24小时内AUC值比200mg QD患者高两倍。每日两次给药后生物利用度增加,可能归因于Sorafenib在水中的低溶解度,导致胃肠道下游部分的吸收减少。因为在每日一次情况下,随着给药剂量的增加,生物利用度达到明显的稳态水平,所以我们选用每日两次的给药方式以达到最佳吸收或提高吸收程度。
剂量比例关系
在低于400mg bid剂量,AUC随剂量提高而上升,通常与剂量有关且与剂量成正比例关系。但是在600mg bid剂量AUC(0-12),ss均值与400mg bid相比并未成比例增加,在800mg bid剂量AUC(0-12),ss均值与600mg bid相比也未成比例增加。
分布
99.5%的Sorafenib与血浆蛋白结合,结合程度与浓度呈线性相关。Sorafenib在红血球和血浆中的分布大致相等,血浆与血液之比为1.33。
消除
为研究Sorafenib的排泄和代谢途径(试验11195),在四位健康志愿者进行了体内质量平衡试验。口服单剂量[14C] Sorafenib后,放射活性检测发现Sorafenib主要经粪便排泄,约占放射活性总量的77%,尿液中占19%。原药是粪便提取物中的主要成分(给药剂量的50.7%),其次是M-6,羧酸化衍生物,占给药剂量的19%。经尿液排泄的19%中,主要成分(14.8%)是Sorafenib葡糖苷酸(M-7),和2.7%的M-2葡糖苷酸—M-8,尿液中未见Sorafenib原药。血浆放射活性总量中,73%以Sorafenib形式进入血液循环,17%为代谢产物M-2,二者药理学活性相似。血浆中其他放射活性代谢产物均低于1%。
活性代谢产物的药代动力学
I 期和II期临床试验研究了Sorafenib的代谢产物M-2、M-4和M-5在癌症患者体内的药代动力学(图5-1)。这些数据表明在400mg bid剂量,多剂量给药后M-2的暴露量约占总暴露量(原药和代谢产物总和)的16%。代谢产物M-2和M-4在给药后7天达到稳态。稳态时代谢产物M-4占总暴露量的8%,M-5占6%。比较代谢产物M-5在给药后第1天和第21天的AUC和Cmax值,发现第21天M-5暴露量的增加高于Sorafenib和M-2(图5-1)。
体内代谢
已完成Sorafenib在大鼠(73),犬(74)和人(63)体内的生物转化试验,结果如表4-5所示。到目前为止,口服单剂量药物后,原药是大鼠,犬和人血浆中的主要组分(在放射活性AUC总量中占71%-73%)。与人相比,大鼠和犬血浆中M-3(BAY 72-1973)居优势地位,分别占放射活性AUC总量的12.1%和15.6%。在人血浆中M-2(BAY 67-3472, N-氧化产物)是主要的代谢产物(AUC总量的16.7%),但仅在大鼠血浆中检测到少量M-2(0.9%),在犬血浆中则未检出。
表4-5:体内生物转化:口服单剂量[14C]标记的BAY54-9085后,大鼠(PH-33292),犬(PH-33063)和人(PH-33427)血浆中的主要组分


a 以[14C]Sorafenib的自由碱基计
AUC 血药浓度时间曲线下面积
在人体,Sorafenib的血药浓度时间曲线出现几个次级峰,表明存在肝肠循环,肝肠循环的出现归因于下述两种过程:
· 药物的葡糖苷酸化产物M-7经胆管分泌到肠,葡糖苷酸产物分解,随后Sorafenib在肠内再吸收。
· 药物的氧化产物M-2经胆管分泌到肠,经结肠菌还原为Sorafenib,随后Sorafenib在肠内再吸收。
仅在人体观察到两种重要的生物转化途径,在大鼠和犬则未发现肝肠循环。大鼠和犬口服[14C]标记的Sorafenib甲苯磺酸盐后,放射活性几乎全部经粪便排泄。在人体约75%的给药剂量经粪便排泄。原药是人(给药剂量的50.7%)和大鼠(32.3%)粪便提取物中的主要组分,但在犬仅占给药剂量的3.5%。在人,大鼠和犬的粪便提取物中,羧酸化产物M-6分别占放射活性总量的19.1%,30.0%和62.6%。羟甲基化产物M-3(BAY 72-1973)几乎是动物体内独有的代谢产物,在大鼠和犬的粪便中分别为23.0%和15.0%。
在人体,经肾脏的排泄比大鼠或犬更为明显。在人的尿液(剂量的19%)中检测到两种代谢产物:M-7,Sorafenib的葡糖苷酸化产物(剂量的14.8%);M-8,M-2的葡糖苷酸化产物(剂量的2.7%)。尿中未发现原药成分。比较Sorafenib在人体和动物的生物转化发现,两条代谢途径在体外和体内存在显著差异。在人体,吡啶的N-氧化反应(M-2, BAY 67-3472)比甲基羟基化反应(M-3, BAY 72-1973)更为显著。Sorafenib的葡糖苷酸化仅在人体内具有重要意义。
综上所述,在人体Sorafenib经两条途径进行生物转化,由CYP3A4催化的M-2的生成以及经由葡糖醛酸转移酶UGT1A9催化的葡糖苷酸化产物M-7的生成。此外,在人肾脏也能生成葡糖苷酸化产物M-7。由于存在两条生物转化途径,一般认为Sorafenib与CYP3A4抑制剂不太可能发生药物间相互作用。在临床试验中,CYP3A4的强效抑制剂酮康唑与BAY54-9085联合用药,对Sorafenib的血药浓度并未产生任何显著影响,最可能的原因是葡糖苷酸化代谢途径发挥了作用(75)。
图 5-1:在给药21天/停药7天的试验(试验10164)中,癌症患者服用600 mg bid剂量的Sorafenib后第1、7、21天,Sorafenib及其代谢产物M-2,M-4和M-5的血药浓度
 上述结果与代谢产物M-5的半衰期较长一致。日本癌症患者在第14天和第28天的数据表明,给药14天后代谢产物M-5达到稳态。假设Sorafenib及其三种代谢产物(M-2、M-4、M-5)有相似的体外药理学活性,而且各占人血浆中所有药物有关物质AUC总量的30%左右,那么在人体血液循环中Sorafenib没有主要的活性代谢产物。
上述结果与代谢产物M-5的半衰期较长一致。日本癌症患者在第14天和第28天的数据表明,给药14天后代谢产物M-5达到稳态。假设Sorafenib及其三种代谢产物(M-2、M-4、M-5)有相似的体外药理学活性,而且各占人血浆中所有药物有关物质AUC总量的30%左右,那么在人体血液循环中Sorafenib没有主要的活性代谢产物。剂量与时间依赖性
剂量依赖性
在I 期单一制剂试验中,分析了血样中的Sorafenib及其代谢产物M-2、M-4和M-5。随着剂量的提高,患者间个体差异相当大,但是Sorafenib在所分析的四种物质(Sorafenib,M-2,M-4和M-5)总量中所占的比例未见明显变化,表明在100mg bid至800mg bid剂量范围内,Sorafenib的代谢具有剂量依赖性。
时间依赖性
在几个临床试验中研究了Sorafenib的药代动力学对时间的依赖性,尤其是试验10164,评价了给药后第1、7、21天的全部血药浓度-时间曲线。这些评价试验的目的是考察连续给药时间对Sorafenib及其代谢产物的药代动力学的影响。试验发现多剂量给药连续7天后Sorafenib的 Cmax和AUC值都不再继续增加。试验10164中,比较给药后第7天与第21天的暴露量,发现多剂量给药后Sorafenib、M-2、M-4的AUC值都不再增加。
代谢产物M-5的形成较慢,因此不可能从第1天起连续检测M-5的浓度。从给药后第1天到第7天M-5的暴露量增加,给药后7天到21天继续增加,但是给药后21天到28天的暴露量相近,说明M-5的暴露量在多剂量给药后21天内达稳态水平。在日本进行的试验10658中,评价了给药后第1、14和28天的药代动力学,发现每日给药两次后第14和28天M-5的Cmax和 AUC(0-12)值相近。试验10658和试验10164的数据表明,给药后第7至10天M-5的暴露量达到稳态。代谢产物M-5的形成较慢与其半衰期较长的事实相符。
总之,试验10164、100277、100283、100342和10658的数据表明,Sorafenib、M-2、M-4和M-5在给药后14天内均达到药代动力学稳态水平。
内在因素的影响
评价了Sorafenib的药代动力学与内在因素的关系,内在因素包括年龄、性别、体重、血清肌酐(以肌酐清除率计)、肝功能(Child-Pugh A级和Child-Pugh B级)以及血清胆红素等,这一回顾性评价使用了I 期和II 期临床试验中Sorafenib治疗组患者的数据,这些试验得到了患者完整的血药浓度-时间数据。Sorafenib的药代动力学与年龄、性别、体重、血清肌酐和血清胆红素没有明显的关系。在Child-Pugh A级和B级患者,Sorafenib的系统暴露量和安全性数据相似。比较Sorafenib在日本和高加索患者的药代动力学,发现Sorafenib在不同患者的暴露量数据在一定程度上重叠。
综上,根据已得到的400mg bid数据,无需根据年龄、性别、体重(范围:51至116公斤)调整给药剂量。
药物间药代动力学相互作用
Sorafenib是细胞抑制性抗癌药物。由于癌症患者通常需同时使用多种药物进行治疗,所以很有必要研究临床上Sorafenib与其他药物的药代动力学相互作用。通过体外代谢/抑制/诱导及P-gp转运和抑制数据来表征药物间潜在的相互作用特性。另外,临床上评价了某些药物间的相互作用。抗癌药物经常和其他抗癌药联合使用,所以试验评价了Sorafenib与其他抗癌药物的联合用药,本文提供了已完成的试验数据。
大量的体外和体内试验评价了Sorafenib的代谢特点。Sorafenib的体外代谢试验确定了I 期和II 期试验中的代谢途径,体内试验研究了Sorafenib对9种人CYP异构体和5种人UDP-葡糖醛酸转移酶的抑制作用。在人体肝细胞体外试验中研究了Sorafenib的酶诱导作用。作为体内评价的一部分,在临床质量平衡试验和癌症患者I 期试验中也研究了Sorafenib的代谢。癌症患者临床试验中考察了Sorafenib对CYP异构体选择性底物的影响。本部分简要总结了上述体外和体内代谢试验的结果。
1)体外代谢数据
体外人肝脏微粒体数据显示, Sorafenib氧化代谢途径I主要由CYP3A4催化,而代谢途径II(与葡糖苷酸结合)主要由UGT1A9催化。代谢产物M-1到M-5是氧化代谢产物,M-6羧酸化代谢产物,M-7和M-8分别是Sorafenib和M-2的葡糖苷酸化产物。
体外试验评价了Sorafenib甲苯磺酸盐对9种人CYP异构体的抑制作用。未见Sorafenib对CYP1A2、CYP2A6和CYP2E1活性产生抑制作用;Sorafenib对CYP2C19、CYP2D6和CYP3A4具有中度抑制作用,Ki值分别为17 M、22 M和29 M;CYP2B6、CYP2C8和CYP2C9的活性受到Sorafenib强有力的抑制,Ki值分别为6 M、1~2 M和7~8 M。Sorafenib对代谢途径II-结合反应催化酶UGT1A1和UGT1A9也具有抑制作用,Ki值为1~2 M。在400mg bid剂量,Sorafenib的稳态血药浓度Cmax均值为16.6 M(7.7 mg/L)。由于Sorafenib的Cmax值高于文献报道的多数Ki值,因此Sorafenib可能对这些CYPs底物的体内代谢具有潜在抑制作用。
临床试验继续评价了受到Sorafenib抑制的CYP通道在临床的相关性。因为Sorafenib通过两条平行的途径进行代谢,所以Sorafenib与单一途径抑制药物联合用药时,暴露量显著增加的可能性较小。酮康唑临床抑制试验结果证实了这一假设,试验未见明显的相互作用。同样,也没有发现CYP1A2和CYP3A4的诱导作用,说明临床上发生酶诱导的可能性很小,与试验10926的结果一致。
2)体外P-糖蛋白(P-gp)抑制数据
Caco-2细胞的通透性评价表明Sorafenib是高渗化合物。Caco-2细胞表达P-gp,Sorafenib从Caco-2细胞底侧顶部,再从顶部底侧转运的渗出比为2.9到4.7。假设Sorafenib有高渗透性,预计少量渗出不会影响它在人体的整体吸收。
体外试验显示Sorafenib甲苯磺酸盐对人体P-gp渗出泵具有相当大的抑制作用。抑制探针化合物洛哌丁胺和双嘧达莫渗出的IC50值分别为0.84µM和1.24µM。在临床试验中,在400 mg bid剂量,Sorafenib的血药浓度高出上述IC50值几倍之多,所以Sorafenib可能对经P-gp途径转运的药物具有潜在抑制作用。双嘧达莫与Sorafenib(102)一样对P-gp具有抑制作用。服用双嘧达莫不会引起地高辛暴露量显著增加,因此Sorafenib与P-gp底物联合用药时,临床上可能不会发生明显的相互作用。与此结论相一致的是有报告指出,P-gp对与药物吸收有关的相互作用来说可能不太重要。(103)
3)CYP3A抑制剂酮康唑对Sorafenib药代动力学的影响
体外试验发现Sorafenib的氧化代谢途径I主要经由CYP3A4催化。由于很多非生命物质通过CYP3A4进行代谢,许多药物间的相互作用也与CYP3A4有关,所以我们考察了CYP3A4的强力抑制剂酮康唑对Sorafenib的影响。该试验中,Sorafenib给药剂量为50 mg,同时每天服用酮康唑400 mg持续7天。结果表明酮康唑并未增加Sorafenib的暴露量(例如血药浓度)(表5-8)。
表 5-8:血浆中Sorafenib的 AUC和Cmax参数,以及这些参数在与酮康唑联用/未与酮康唑联用时的比值(几何最小平方均值) (试验 10927)
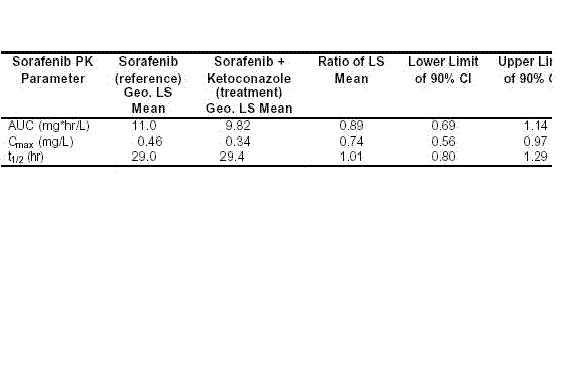 AUC = 血药浓度-时间曲线下面积
AUC = 血药浓度-时间曲线下面积CI = 置信区间
Cmax = 最大血药浓度
PK – 药代动力学
Geo. LS mean = 几何最小平方均值
t1/2 = 半衰期,与血药浓度-时间曲线末端斜率有关。
与酮康唑联合用药时,Sorafenib的暴露量未见增加,因此可以推断经由CYP3A4催化的氧化代谢途径I在Sorafenib的代谢中不太重要。这些数据结合III期试验(试验11213)数据,该试验中41位Sorafenib治疗组患者与19位安慰剂组患者同时服用CYP3A4抑制剂,结果表明临床上Sorafenib与CYP3A4底物和抑制剂联合用药是安全的。
酮康唑是P-gp转运的强力抑制剂,由于临床试验中未见酮康唑对Sorafenib的药代动力学产生任何影响,所以可推断P-gp转运对于血浆中Sorafenib的药代动力学来说并不重要。
与其他抗癌药物联用的相互作用试验
未见Sorafenib与吉西他滨或奥沙利铂发生一致的或有意义的药代动力学相互作用,表明Sorafenib可以与吉西他滨或奥沙利铂联合用药。
Sorafenib与阿霉素联合用药,阿霉素在HCC患者的AUC均值增加了21%。尚不清楚这种相互作用是否具有临床相关性。
Sorafenib与依立替康联合用药,依立替康的活性代谢产物SN-38的暴露量显著增加(67%到120%),SN-38经由UGT1A1进行代谢。这种相互作用的临床相关性未明。
4)体内评价细胞色素P450对Sorafenib的抑制作用
正在癌症患者进行的临床试验(试验10926)中,患者长期服用Sorafenib,考察单一CYP异构体抑制作用是否具有临床相关性,考察了Sorafenib 对CYP2C19(奥美拉唑), CYP2D6(右美沙芬)和CYP3A4 (咪达唑仑)探针底物的影响。
癌症患者多次服用400 mg bid剂量的Sorafenib后,CYP3A4(咪达唑仑)、CYP2D6 (右美沙芬)和CYP2C19(奥美拉唑)探针底物的药代动力学均未发生显著变化。因此临床上Sorafenib既非CYP2C19、CYP2D6、CYP3A4同工酶的抑制剂,也非它们的诱导剂。Sorafenib不会显著增加或减少经由这些途径代谢的化合物的暴露量。
体外试验中Sorafenib可抑制CYP2C9,Ki值为7-8µM。由于S-华法令主要通过CYP2C9途径代谢,在试验11213中,通过PT-INR方法间接检测Sorafenib对华法令代谢的影响。PT-INR参数在Sorafenib组与安慰剂组未见差异,说明在体内Sorafenib可能并非CYP2C9的抑制剂。








