您现在的位置: 百济新特药房网首页 >> 行业资讯 >> 媒体报道
首仿药掀创新风暴,药企争抢千亿市场!
- 来源: 百济药房药讯 作者:百济动态 浏览: 发布时间:2017/10/25 16:50:00
原标题:首仿药掀创新风暴,齐鲁、正大天晴、恒瑞争抢千亿场!
一边是中国制药界的“研发一哥”恒瑞,一边是“老大哥”石药集团,无论谁率先获得“首仿药”批文,拥抱它的,至少是每年数千万美元的中国市场。
而这仅仅是2015年8月,中国药品审评审批综合改革启动后,本土各大药企,对首仿药展开激烈角逐的缩影。
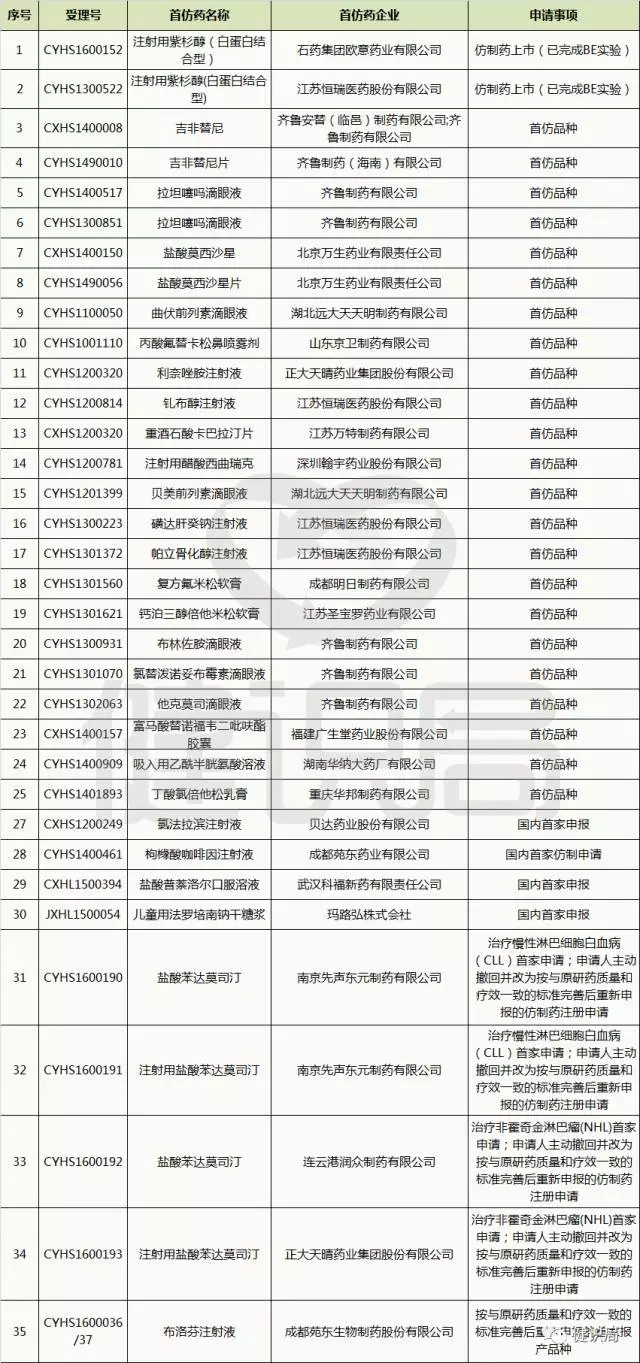
健识君统计,2016年1月29日,自国家药品审评中心(以下简称CDE)公示首批纳入优先审评审批的药品名单至今,23批共计263个国家优先审评审批药品中,陆续涌现出35个首仿药,涉及20家企业。
其中,既有石药、齐鲁、恒瑞、正大天晴等本土药业研发“梯队”,也有北京万生药业、成都明日制药这些“新鲜面孔”。
上述数据突显,一场由本土药企“接棒”的,全球“明星”原研药抢仿战役,已经拉开。
瞄准首仿药
石药恒瑞启动暗战模式
美国的《药品价格竞争和专利期恢复法》中明确,首仿药是在“专利无效或者批准正在申请的药物不会侵犯专利”的情况下,个仿制申请者将拥有180天的市场专卖权。
事实上,首药物的研发难度和成本都明显低于创新药,产品疗效已充分被原研药验证。此时,首仿药一旦上市,有望凭借低廉的价格迅速占领市场,甚至可以替代昂贵的原研产品成新任霸主。
这桩“投资少、风险低、见效快”的买卖,目前已为中国传统药企转型升级,新兴药企开疆拓土的“必争之地”。在上述35个进入国家优先审评序列的首仿药产品中,健识君发现,CDE在2016年10月公示的《拟纳入优先审评程序药品注册申请的公示(第十一批)》中,恒瑞医药注射用紫杉醇(白蛋白)以首仿品种位列其中。
第十一批拟纳入优先审评程序药品注册申请的公示名单


5个月后,2017年3月,CDE第十四批拟纳入优先审评程序的药品注册申请公示中,石药集团研发的同种产品——注射用紫杉醇(白蛋白)也以“首仿”为由之一,列入优先审评审批。
第十四拟纳入优先审评程序药品注册申请的公示名单


根据首仿药只能审批一家企业的国际通行原则,石药集团与恒瑞医药的首仿药之争已经打响。
随后,健识君发现,在2017年6月20日,恒瑞医药与石药集团申报的注射用紫杉醇(白蛋白),又双双列入拟纳入优先审评审批名单,此次恒瑞医药用了新的受理号,而石药集团仍用之前的受理号。此次纳入理由是临床急需、市场短缺。
第二十批拟纳入优先审评程序药品注册申请公示名单
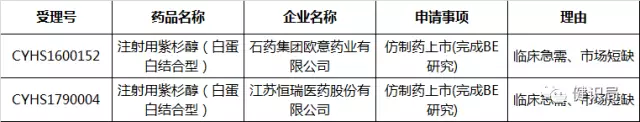

从公开信息看,恒瑞医药和石药集团均已完成注射用紫杉醇(白蛋白)的仿制药BE试验,并纳入优先审评审批绿色通道。加之是市场短缺药品,无论终谁率先抢仿成功,迎接它的,都将是年销售收入以亿元计的巨大市场。
恒瑞医药公告显示,2016年,注射用紫杉醇(白蛋结合型)在中国市场销售额约为3448万美元,全球市场销售额约为10亿美元。
竞争激烈
本土药企向跨国药企“开炮”
在35个首仿药优先审评审批名单中,齐鲁制药以7个品种一枝独秀,成为申请首仿药审评注册数量多的企业,而江苏恒瑞、正大天晴、石药集团紧随其后形成首仿药角逐“战团”。
在这场首仿药的优先审评角逐中,江苏恒瑞和石药分别申请的注射用紫杉醇(白蛋白结合型),恒瑞申请的帕立骨化醇注射液,正大天晴申请的利奈唑胺注射液,齐鲁制药申请的拉坦噻吗滴眼液,都属于“明星”产品,跨国药企的原研药,已创下每年以亿美元计的巨大市场。
以注射用紫杉醇(白蛋白结合型)为例,由新基医药(后被百济神州收购)研发生产的原研药,在2015年中国市场销售额约为3614.2万美元,全球市场销售额约为9.9亿美元;辉瑞拥有的原研专利产品——利奈唑胺注射在全球市场的销售规模则高达14亿美元。
分析人士指出,“上述首仿药一旦成功上市,必将迫使原研药在中国甚至全球市场降价,以挽留市场,这些明星药的学术营销大战一触即发。”
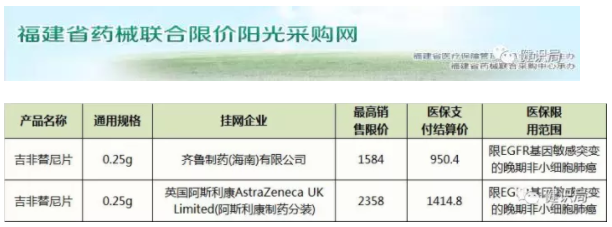
2016年12月,齐鲁制药旗下吉非替尼片的首仿药——“伊瑞可”成功上市之后,迫使阿斯利康的原研产品“易瑞沙”从之前的15000元降至约7000元。近日,健识君查询福建省药械联合限价阳光采购网发现,易瑞沙新的零售价仅为2358元,降幅近90%。
实际上,在中国医药改革多项政策的冲击下,跨国药企的“明星”原研药,已迎来降价潮。
2017年8,上海罗氏制药有限公司宣布,该公司治疗非小细胞肺癌的靶向药物特罗凯(厄洛替尼)将降价30%,具体的降价幅度可能因各地基础价格差异而略有不同。目前,特罗凯的报价约为4600元/盒/7片(150mg)。
而2016年、2017年,国家卫计委、人社部分别组织的两轮药价谈判中,GSK旗下治疗慢性乙肝的富马酸替诺福韦二吡呋酯(韦瑞德)降价67%;阿斯利康研发生产治疗晚期非小细胞肺癌的盐酸吉非替尼(易瑞沙)降价55%;诺华制药将其重磅产品雷珠单(诺适得)在中国医院终端的价格从9800元/支调低至7200元/支,每支降价2600元,降幅达26%。
跨国药企之所以在中国市场频繁降价,表面上来看原因各异,受医改政策影响较大,但本质上,还是迫于中国药企的创新性竞争压力。业内普遍认为,首仿药的陆续上市,让跨国药企的“超国民待遇”逐步消失。
政策红利
首仿药角逐千亿市场
2015年8月,国务院出台《关于改革药品医疗器械审评审批制度的意见》,正式启动药品审评审批改革,重新定义新药和仿制药,开创药品优先审评审批“绿色通道”,鼓励药企在中国研发创新。
到今年10月9日,中办、国办联合发布《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,本土药企在首仿药领域的研发竞争,已蔚然成风。
由于首仿药与原研药在质量和疗效一致性上的“榜样”作用,我国的药改,已逐渐梳理出:鼓励首仿、强力推进仿制药一致性评价两大改革“举措”。
国家食药监总局局长毕井泉多次提出,本轮药品审评审批改革的主要目标,就是让中国的仿制药在质量和疗效上与原研药一致,在临床上可以相互替代,既可以节约医疗费用,同时提升制药行业的整体发展水平,促进制药工业供给侧结构性改革。
这也意味着,首仿药,特别是进入优先审评审批通道的首仿药,一出生(获批上市),即可优先享有目前仿制药一致性评价的政策红利
2016年3月,国务院办公厅印发《关于开展仿制药质量和疗效一致性评价的意见》明确指出,通过一致性评价的药品品种,在医保支付方面予以适当支持,医疗机构应优先采购并在临床中优先选用。同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
纵观国际,美国的首仿药鼓励政策包括,企业申报审批成功,将获得180天的“首仿独占期”,在此期间,FDA不会批准其它仿制药的申请,首仿药企业可利用此“独占期”,进行充分市场布局,从中获利。
对此,业内普遍认为,国外通行的180天独占期与国情不相符,因为从新药获批上市,到经过集中采购进入临床、进入医保,都远不止180天;或许,1至3年更为可行。
分析人士指出,在政府大刀阔斧鼓励创新的今天,给予首仿药更多利好政策,并非“奢望”。恒瑞、正大天晴、齐鲁,这些本土首仿药“当家”企业,可坐收政策红利。
在国际药品市场上,中国的首仿药仍是“新绿”,但已经“榜样”产品,充分发挥首仿药的性价比优势,和本土市场营销优势,成功超越原研药,或取得与之相当的市场份额。
以江苏奥赛康药业为例,2009年,其拳头产品奥西康——国内首仿阿利斯康原研药注射用奥美拉唑钠(洛赛克)上市。在之后的三年中,奥西康在江苏等多省药品招标采购中,中标价格近60元,与相比于国内其他100多家生产商7-7.5元市场零售价,首仿药的价格是同类产品的9倍。
浙江震元生产的氯诺昔康为国内首仿药,目前已独占国内市场70%的份额;华海药业研究院研发的拉莫三嗪控释片为国际首仿药,于2013年1月取得美国ANDA文号,上市当年就给公司贡献1.5亿美元。另据华海药业2016年报显示,拉莫三嗪控释片销售额为1891.95万片(约合15.17亿美元)。
目前,在注射用紫杉醇(白蛋白结合型)的首仿审评“争夺战”中,同时进入优先审评序列的江苏恒瑞和石药集团仍在与时间赛跑,稍有不慎,或错失千万级甚至亿级美元市场。
分析人士预测,未来5年,中国首仿药将持续研发、审评、审批、上市的步伐,首仿药的产品总数有望突破100个品种。
从国际市场看,随着跨国药企利悬崖的到来,2014—2020年的7年间,将有2590亿美元的药品面临专利到期的风险,其中预期有46%的市场份额会被仿制药替代。
来源:健识局(jianshiju01) 作者:雷公
本文为转载,我们不对其内容和观点负责。








