多吉美专题 >> 多吉美临床前动物毒理学研究
多吉美临床前动物毒理学研究
- 来源: 百济新特药房网 发布时间:2007-3-13 14:10:00
为考察Sorafenib(甲苯磺酸盐形式)的毒理学和毒代动力学性质,进行了全面的非临床试验研究(表4-6)。考虑到特定的适应症(如癌症患者),试验设计主要侧重于研究幸存者的MTD和发生不良反应的最低水平(LOAEL),其次是确定本品对所有毒性靶器官的明显无效水平。
动物试验所选择的给药途径是口服,与人体给药途径一致。在大鼠、小鼠和犬进行了单剂量毒性/耐受性试验。为给患者长期用药提供数据,重复用药毒性试验在大鼠、小鼠和犬进行,试验周期在大鼠为每日给药连续6个月,在小鼠为连续服用3个月,在犬为12个月。亚急性毒性试验在大鼠(4周和13周)和犬(4周)进行,为考察作用的可逆性和延迟效应,在治疗后继续观察4周。在大鼠和兔进行了一系列标准的遗传毒性试验和胚胎-胎儿发育毒性试验。
在上述试验计划之外,进一步补充了试验数据,因为随着对Sorafenib研究的深入,一些与毒理学有关的问题日益明显,比如特异性靶器官(骨,牙齿和胰腺),代谢产物和杂质的毒理学性质。考虑到本品的临床应用以及目前得到的试验数据,无需进行某些深入研究,如长期致癌性试验或生殖毒性试验(生育力和围产期/出生后试验)。为考察人体内主要代谢产物M-2(BAY 67-3472)的终末端毒性,单独进行了M-2的毒理学试验(在最敏感物种-大鼠进行了致突变试验和重复用药毒性试验)。根据公司化学品分类原则,在BAY43-9006(自由碱基)的合成过程中进行了常规职业安全性和危害评价;这些试验结果列在本文中,作为非临床试验中与安全性有关的补充资料。
表4-6:Sorafenib的毒理学试验方案
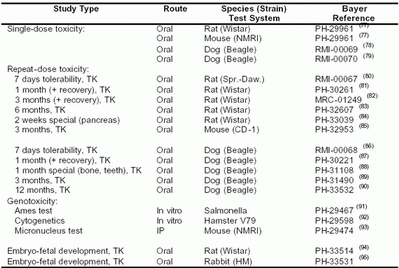
TK:毒代动力学评价
IP:腹膜内
注:上标中的所有数字参见拜耳内部试验报告
Sorafenib的非临床安全性资料总结如下:在多数应用较高剂量的毒理学试验中,系统暴露量低于随剂量成比例增加的程度,表明在物种间进行比较时,以mg/m2体表面积表示剂量比血药浓度更为恰当。毒理学响应的定性和定量分析在雄性和雌性动物间未见显著差异。在大鼠,小鼠和犬,短期大剂量治疗有良好的耐受性。在大鼠和小鼠,依赖于暴露量的发病率和死亡率(平均死亡时间≥3周)并未出现上述特征。在犬,胃肠毒性受到剂量的限制。除了在犬发生的皮肤反应和血样便之外,与毒性有关的临床指征十分普通。本品对CNS机能并未产生相应作用。Sorafenib对心血管系统,尤其是对心脏复极化的影响似乎不可能在人发生在。在动物试验中,血液学和临床血液化学常规参数的变化并不表示有特异性器官损害发生。肝毒性的血清标志物很明显,但并未持续升高。组织病理学观察发现,包括肝脏,肾,淋巴网状结缔/造血系统,胃肠道,胰腺,肾上腺,生殖器官,皮肤,牙齿和骨骼在内的多个器官发生退化和再生现象。以接近或超过致死量的剂量重复给药后,大多发生与毒理学有关的损害。发生显著损害的阈值剂量随疗程的延长而降低。大多数形态学损害完全可逆或至少具有好转趋势。每日给药持续4周或13周后,在为期4周的恢复期末期仍可观察到少数结构性变化(如胆管增生,肝纤维化,以及对淋巴网状结缔系统的影响)。在体外和体内遗传毒性试验中,未见任何明显的遗传毒性指征。在幼犬进行的重复用药毒性试验结果表明,由于对骨和牙齿的结构、组成产生影响,因此不能排除本品可能对儿童和青少年具有潜在危害。重复用药一般毒性试验,胚胎-胎儿发育试验和组织分布试验结果表明,本品对男性和女性的生育力,对孕期和哺乳期妇女具有潜在危害。
|
要点:
· 耐受性和MTD随治疗持续时间的延长而降低
· 重复用药试验发现,在癌症患者的推荐剂量:每日两次,每次400mg范围内或低于此剂量及相应的血药浓度下,多个器官和组织发生不良反应。
· 某些形态学显著变化并未在临床上引发相应的症状(存活期内)。
· 根据在成长期动物进行的试验,本品对儿童、青少年的骨骼和牙齿的结构和组成具有潜在危害。
· 重复用药一般毒性试验,胚胎-胎儿发育试验以及组织分布试验结果表明,本品对男性和女性的生育力,对孕期和哺乳期妇女具有一定危害。
· 代谢产物并未对Sorafenib的毒理学资料产生相应影响。
· 药物中的杂质浓度超出安全性范围时具有一定的毒性。 |
单剂量毒性
在雄性或雌性大鼠和小鼠,单次口服最高剂量为1460mg/kg的Sorafenib(相当于2000mg/kg的甲苯磺酸盐)后仍能耐受,未见任何毒性指征(77)。在犬,单次口服120mg/kg剂量的Sorafenib溶液剂(相当于165mg/kg的甲苯磺酸盐),以及单次口服1000mg/kg剂量的Sorafenib粉末剂(相当于1370mg/kg的甲苯磺酸盐)均有良好的耐受性;唯一的毒性反应是呕吐(78, 79)。在其他试验中得到的药代动力学数据表明,系统暴露量在较低的口服剂量就能达到饱和极限。未进行非肠道给药(IV)单剂量毒性试验,因为Sorafenib或Sorafenib甲苯磺酸盐在IV溶媒中的溶解性很低。
重复用药毒性
1)啮齿动物
在大鼠每日一次连续给药7天,高达125mg/kg的剂量仍有良好的耐受性(80),短期暴露几乎未见或未见任何与临床有关的毒性指征,尽管在一些器官和组织血液学、临床化学和形态学发生改变。
在大鼠重复用药毒性试验中,给药方式为每日一次口服给药。在为期3个月的试验中,在5mg/kg剂量发生死亡事件(82)。在为期6个月的长期毒性试验中(83),在Sorafenib的最高剂量(2.5mg/kg/天)未发生死亡,因此认为此剂量是大鼠长期用药的MTD。包括肝,肾,胰腺,淋巴网状结缔/造血系统,胃肠道,肾上腺,牙齿,骨和生殖器官在内的多个组织发生依赖于剂量的退化和再生现象(程度多为最小到中度)。在大鼠不能全面评价恢复程度,因为在包括高剂量恢复组在内的两个试验中,较早发生死亡,且死亡率较高。在大鼠经3或6个月的治疗后,形态学无效剂量水平低于10mg/kg。在长期试验中,在最低重复用药剂量0.1mg/kg/天,本品对牙齿具有轻度影响(牙质退化),且发生率较低。血液学和临床化学变化并不表示有器官损害发生。在大鼠为期6个月的试验中(83),一系列室外观察和机能评价均未见任何神经毒性指征。在大鼠为期2周的试验中,集中研究了Sorafenib对胰腺的影响,血清α淀粉酶升高以及胰腺的形态学变化表明,胰腺是潜在的毒性靶器官(84)。
在小鼠连续3月每日服用一次30mg/kg剂量的Sorafenib,临床上仍能耐受,未见任何与临床有关的或组织病理学严重毒性指征(96)。MTD为100mg/kg/天。在多个组织可见依赖于剂量的退化/再生现象;主要毒性靶器官似乎是淋巴网状结缔/造血系统,牙齿,肝,肾上腺和胃肠道(胃)。
2)非-啮齿动物
在犬每日一次连续给药7天的试验中,口服高达60mg/kg剂量后有良好的耐受性(86),短期暴露较少或未见任何临床毒性指征,尽管在一些器官和组织发生血液学和临床化学参数改变和形态学变化。在犬,每日两次给予高剂量药物(总量达120mg/kg/天)持续7天,出现难以耐受的明显指征(呕吐,腹泻,震颤和体重减轻)。
随后在犬进行的4周试验中,初始剂量为每日两次,每次给予10,30或60mg/kg剂量的Sorafenib,30mg/kg bid和60mg/kg bid(每日总剂量分别为:60和120mg/kg)明显超出MTD水平(87)。呕吐,血样便和体重增量减少使得上述给药剂量难以持续1周-2周以上;因此在1周后将剂量减少到每日给药一次。除了对胃肠道(血样便)的影响和对皮肤的明显作用(脱发和炎症)以外,在犬每日1次,每次服用高达30mg/kg的剂量持续3或12个月,临床上有良好的耐受性(89, 90)。在肝和皮肤观察到明显的形态学改变。经3或12个月的治疗后,形态学无效水平低于10mg/kg/天。在此剂量水平观察到肝脏(胆管增生)和皮肤(毛囊退化)的某些形态学发生变化。在犬长期毒性试验所使用的最低剂量水平(3mg/kg/天)仍观察到轻度皮肤反应。组织病理学观察发现,在包括肾,淋巴网状结缔/造血系统,胃肠道,肾上腺,牙齿和骨在内的多个组织发生与剂量有关的退化和再生现象(多数为最轻到中度)。在幼犬观察到本品对骨(股骨生长板增厚)和牙齿(牙质组成改变)的影响(88)。经4周治疗后观察到的一些作用(肝,脾和牙齿),在随后的4周内仍不能完全恢复(87)。在犬重复用药试验中,临床化学和血液学分析发现,这些主要变化表明本品对肝功能和肝结构产生影响。
遗传毒性
1)沙门氏菌/微粒体评价
2)体外细胞遗传学试验
3)微核试验
致癌性
生殖和发育毒性
未进行特异性生育力试验,未进行包括母体机能在内的早期胚胎发育或出生前后(围产期)发育试验。在重复用药毒性试验中,组织病理学观察发现Sorafenib可通过影响雄性和雌性动物的生殖器官而削弱其生育力。在为期1个月,3个月和6个月的毒性试验中,对生殖器官的多种作用包括:在雄性大鼠,睾丸内输精管退化和附睾精子数减少;在雌性大鼠,卵巢发育迟缓和黄体中心性坏死(81-83)。在25mg/kg/天剂量出现明显的,治疗引起的作用。在犬进行的为期12个月的毒性试验中,在30mg/kg/天剂量出现输精管退化,在60mg/kg/天剂量附睾内精子数减少(90)。
在大鼠(94)和兔(95)进行了发育毒性试验。在大鼠试验中,雌鼠在受精后第6-17天服用0,0.2,1或2.5mg/kg/天剂量的Sorafenib。在2.5mg/kg剂量组发生明显的,治疗引起的对子宫发育的影响,且受孕率降低(晚期再吸收),幸存的受精卵着床后流产率增加(晚期再吸收),从而导致平均产仔量减少,胎盘边缘坏死和胎盘失血量增加,胎盘和胎儿重量降低。与胎儿体重降低相比,胎儿骨骼骨化迟缓,外观和脏器畸形(外观苍白,无名动脉消失)以及骨骼变异(多余的第14肋骨)的发生率增加。在2.5mg/kg剂量组,常见的胎儿畸形的发生也更为频繁。在1mg/kg剂量组,前蹄,胸骨和胸椎骨的个别骨骨化迟缓以及食道后主动脉弓畸形的发生不能排除与治疗的关系。在2.5mg/kg/天剂量组观察到母体机能数据。
在兔试验中,雌兔在受精后第6-第20天服用0,0.3,1或3mg/kg/天剂量的Sorafenib。在3mg/kg剂量组观察到明显的母体反应。在0.3mg/kg和1mg/kg剂量水平,雌兔耳部可能失去知觉的发生率增加,而且不能排除这一现象与治疗的关系,该试验未确定母体系统的NOAEL值。在3mg/kg剂量观察到本品对胚胎/胎兔发育的影响,包括再吸收,胎盘部分坏死,着床后后流产率增加,胎儿数量减少以及性别分布改变,雄性率为40%。在3mg/kg剂量,常见的胎儿畸形(主要是肾,椎骨和肋骨畸形),胸肌融合以及颈椎、前额骨骨化迟缓的发生率提高,假定这些影响与治疗有关。
局部耐受性
因Sorafenib在人体为口服给药,未专门进行局部耐受性试验。大量的Sorafenib(BAY 43-9006自由碱基)直接用于兔的皮肤和眼睛,未见任何局部刺激或损害(97, 98)。在小鼠皮肤(耳)使用后未发生任何刺激或过敏反应(99)。
其他毒性试验
为表征人体内主要代谢产物(M-2,BAY67-3472)的毒理学性质,单独进行了代谢产物试验。M-2的Ames试验为阴性(100)。为研究其系统毒性,在大鼠进行了4周试验,在Sorafenib的毒理学试验中,大鼠是最敏感的物种(101)。在试验中,每日给予1、5或25mg/kg剂量的M-2。与相同试验条件下,口服同样剂量的Sorafenib在4周试验中的结果相比,代谢产物通常有良好的耐受性,临床上较少引起病理学和形态学改变。没有任何迹象表明人体内代谢产物M-2比母体化合物Sorafenib毒性更大,实际上,这一代谢产物的毒性低于Sorafenib。
1)潜在的毒性靶器官
在动物观察到的多个毒理学作用可能会影响在人体进行的风险评估。本部分详细讨论了这些数据,尤其是对肝脏,肾,胃肠道,心血管系统,淋巴网状结缔/造血系统,肾上腺,生殖器官,牙齿,骨和皮肤的影响。
肝脏:犬,大鼠和小鼠口服多剂量药物后,观察到本品对肝脏的影响,表现为肝功能参数变化和形态学改变均与剂量有关。在犬观察到最显著的作用。在犬4周试验中,与肝脏有关的酶的血清水平(特别是丙氨酸转氨酶[ALT],天冬氨酸转氨酶[AST],谷氨酸脱氢酶[GLDH]和碱性磷酸酯酶[ALP])明显提高(87)。在亚慢性或长期毒性试验中,较长时间的治疗后上述标记物的血清水平未见明显改变,且未见任何恶化症状。在犬进行的所有重复用药试验中,观察到单核细胞坏死和胆管增生在内的组织病理学变化;在少数动物长期(12个月)服药后发生肝硬化。用于优化系统暴露量的溶媒中含有相对大量的有机溶剂,药物和溶媒的联合作用可能会强化某些肝脏变化。经4周治疗后,在随后的4周内某些变化,尤其是胆管增生和纤维化未能完全恢复。在肝脏发生与毒理学有关的不良反应的最低剂量(LOAEL)或系统暴露量,在大鼠3个月试验中是5mg/kg/天(89),在犬12个月试验中是10mg/kg/天(90)。因为在癌症患者,按常规应监测肝功能参数,因此最有可能检测到治疗引起的任何肝功能改变。
肾:在大鼠进行的单剂量药理学安全性试验中,观察到抗利尿剂作用(如排尿量减少达56%,同时钠和氯排出量减少;同样血液红细胞计数,红细胞压积和Hb总浓度降低)。在300mg/kg的高剂量,这种作用具有统计学显著性;此剂量下的暴露量超出每日两次每次服用400mg Sorafenib 后在人体的暴露量。在重复用药毒性试验中,组织切片在显微镜下可见肾病指征。有时尿样分析发现本品对肾脏的影响,但血清中肾功能改变的标志物却不显著。经4周治疗后,在随后的4周内一些形态学变化(在大鼠4周试验中,在超出MTD的剂量,描述为嗜碱性肾小管管状膨胀)并未完全恢复。这些变化表明在大鼠,仅在接近或超出MTD的剂量对肾功能的影响较为突出。引起与毒理学有关的形态学变化的LOAEL,在大鼠6个月试验中是1mg/kg/天(83),在犬12个月试验中是10mg/kg/天(90)。因为在癌症患者,按常规应监测肾毒性标记物,因此有可能检测到任何与治疗有关的肾功能变化。
包括外分泌胰腺在内的胃肠道:犬单次服用大剂量药物后出现呕吐。在犬重复用药试验中,胃肠道(呕吐,血样便)反应似乎受到剂量的限制。在小鼠3个月试验中(85),口服30,100或300mg/kg/天剂量后,胃部出现治疗引起的明显改变,包括与剂量有关的弥漫性增生和角化过度。为得到完整的毒理学资料,大剂量药物溶于含有有机溶剂的大量溶媒中口服给药,因此本品对胃粘膜的刺激可能属于局部作用,而非系统反应。在重复用药试验中,组织病理学观察大鼠和犬的肠道,可见轻度退化和再生性改变。在接受Sorafenib治疗的癌症患者,同样发生胃肠不耐受性。
在大鼠和小鼠重复用药试验中,发现外分泌胰腺的形态学发生变化,在Sorafenib的临床试验中血清淀粉酶和脂肪酶水平升高。在大鼠重复用药试验中(84),以强饲法连续2周每日给予5或25mg/kg剂量的Sorafenib,专门研究了本品对这些参数可能存在的影响。结果表明Sorafenib对大鼠的外分泌胰腺具有中度作用,血清α-淀粉酶水平出现瞬时升高。在大鼠每日口服给药,疗程在2周以上的毒性试验中,胰腺形态学在高于MTD剂量发生明显改变;每日口服低于或等于MTD剂量的Sorafenib,连续治疗1,3或6个月后,显微镜下观察未见任何一致性变化(81-83)。因为在临床设计中需监测本品对外分泌胰腺的影响,所以本品对人体的作用不具有显著意义。
心血管系统,心脏安全性非临床评价(QT间隔):在体外药理学安全性试验中,进行hERG检测时出现的信号表明本品对心电图QT间隔具有潜在影响。但是在动物,包括其物理学模型与人体相关的犬体内试验中,根据心电图记录,临床病理学或组织病理学观察所见,未发现任何心血管毒性指征。根据上述试验结果,Sorafenib对心血管系统,尤其是对心脏复极化的影响似乎不可能在人体发生。
淋巴网状结缔/造血系统:在重复用药毒性试验中,血液学和组织病理学观察未见任何淋巴网状结缔/造血系统毒性指征。在相对较低的剂量水平,观察到骨髓,胸腺和脾脏的形态学发生变化,以及本品对白细胞,红细胞参数和凝血功能产生影响。在等于或高于MTD剂量,上述作用为轻到中度。这一现象与细胞毒类抗肿瘤药物治疗后产生的作用正好相反。
肾上腺:大鼠,小鼠和犬服用接近或超过MTD剂量,重复用药后发现肾上腺形态学发生变化,包括出血和坏疽现象,最可能的原因是受影响的动物健康条件较差。
生殖系统:重复用药毒性试验结果表明,Sorafenib能削弱动物的繁殖能力和生育力,并对雄性和雌性动物的生殖器官产生各种不同作用,其中大鼠比小鼠或犬更为敏感。在大鼠为期4周的试验中,典型作用包括睾丸,附睾,前列腺和精囊退化以及发育迟缓(在25mg/kg/天剂量较为明显和显著,临界作用始于1mg/kg/天)(81)。在大鼠3个月试验中(82),在雌鼠发生黄体中心性坏死和卵巢发育不良(LOAEL为5mg/kg/天)。在犬12个月试验中(90),在30mg/kg/天剂量出现输精管退化,在60mg/kg/天剂量精子数减少。大鼠(94)和兔(95)发育毒性试验表明Sorafenib具有明显的胎儿毒性(着床后流产,再吸收,骨骼发育迟缓,胎儿体重增量缓慢)。此外,本品还具有潜在的致畸性(常见的,分布广泛的畸形,以及某一外观和内脏畸形)。这些作用发生在远远低于人用临床治疗剂量的水平(大鼠的LOAEL为1mg/kg/天,兔为3mg/kg/天)。在哺乳期大鼠进行的组织分布试验中,乳汁中含有高浓度的Sorafenib及其代谢产物(乳汁/血浆水平之比约为5)。因为在动物试验中观察到生殖毒性,Sorafenib不宜用于孕期妇女。建议患者在治疗时应采取措施避免受孕,建议哺乳期妇女在服用Sorafenib时不宜母乳喂养。
骨,牙齿:幼犬多次服用本品后,骨和牙齿的发育发生多种变化,包括股骨生长板不规则增厚(LOAEL为30mg/kg/天),此生长板附近骨髓细胞减少(LOAEL为10 mg/kg/天),以及牙质组分改变(LOAEL为30 mg/kg/天)。因为试验中使用的是幼年和发育期动物,另外在老年犬进行了试验,评价本品对不同发育阶段的作用(88)。成年犬连续4周内每日服用60 mg/kg剂量的Sorafenib。与以前在幼犬进行的试验相比,在成年犬未见股骨或牙齿形态学发生与治疗有关的改变。在大鼠和小鼠,观察到本品对牙齿的明显作用,包括牙质组分改变。在啮齿动物得到的数据很难外推到人,因为与人类相反,小鼠和大鼠的牙齿,特别是门牙终生都在生长。但是,可以得出结论:本品对儿童或青少年的骨骼和牙齿具有潜在危害。
皮肤:在犬重复用药试验中,在开始服药后的第4-8周,皮肤开始出现明显损害,并伴有脱发和炎症。在犬12个月毒性试验(90)中,在10mg/kg/天剂量出现轻度脱发,而在30或60mg/kg/天剂量头发几乎完全脱落,脱发还伴有躯干和腋窝部位皮肤发红。在出现明显反应的动物,显微镜下观察其皮肤断面,可见皮炎和毛囊萎缩/退化,常伴有外周毛囊炎,偶有棘皮症。在犬12个月试验中发生意外死亡事件,原因可能是皮肤的正常保护功能受到干扰,从而间接引起全身性感染。在服用3mg/kg/天剂量Sorafenib的雄性犬,也观察到极轻微的皮炎和轻度秃头症/毛囊退化。在大鼠或小鼠未见类似变化。尚不清楚在犬观察到的皮肤反应与人体数据是否具有相关性(如手-足皮肤反应)。
在动物重复用药试验中,毒理学主要终末端,以及能引起毒理学有关作用的(如LOAEL),以mg/kg/天和mg/m2/天表示的最低剂量数据汇总在表4-7。相应的稳态血药浓度(AUC)列在表4-8。因为Sorafenib与血浆蛋白高度结合,且与物种有关(未结合部分:小鼠和大鼠为0.5%,犬0.9%,人0.5%),血药浓度总量以及未结合部分浓度均列在表中。
比较各动物在重复用药毒性试验中的数据发现,小鼠对于所有毒理学终点最不敏感。对于死亡率和其他多数毒理学参数,大鼠比犬更为敏感。长时间服用接近或超过致死量的药物后观察到很多反应,因此至少可以部分归因于动物的身体状况较差。一些数据对于某一物种来说更为显著或具有特异性。例如,对皮肤的作用仅在犬发生;血液学作用以及对生殖器官的损害在大鼠更为突出;与其他物种相比,在较低的系统暴露量,本品对犬肝脏的作用较为广泛。
在临床试验中,癌症患者连续每日口服400mg bid剂量的Sorafenib(对于60kg体重的患者,相当于13.3mg/kg/天或500mg/m2/天)后,Sorafenib的总血药浓度均值约为130mg.h/L(AUC0-24h),稳态Cmax约为7.7mg/L。在人体服用400mg bid剂量的Sorafenib后,血浆中Sorafenib未结合部分的浓度以AUC0-24h,未结合计约为0.65 mg.h/L。在动物亚慢性或长期毒性试验中,能观察到显著毒性的剂量水平以及Sorafenib相应的血药浓度均低于癌症患者服用推荐剂量400mg bid后的水平。
表4-7:Sorafenib:在动物每日给药,至少持续4周的重复用药毒性试验中,观察到不良反应的最低水平(LOAEL)
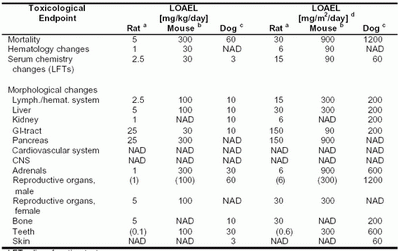
LFT=肝功能检查
LOAEL=能观察到不良反应的最低水平
NAD=在考察的最高剂量,未见与毒理学有关的异常现象
() 临界效应,发生率和/或严重程度较低
a 剂量范围:0.1,1,2.5,5,25,125 mg/kg/天
b 剂量范围:30,100,300 mg/kg/天
c 剂量范围:3,10,30,60mg/kg/天
d 小鼠:1mg/kg=3mg/m2;大鼠:1mg/kg=6mg/m2;犬:1mg/kg=20mg/m2;
表4-8:在动物每日给药,至少持续4周的重复用药毒性试验中,在能观察到不良反应的最低剂量水平(LOAEL),血浆中Sorafenib的总暴露量和未结合部分暴露量
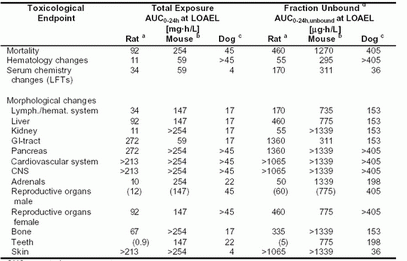 CNS=中枢神经系统
CNS=中枢神经系统GI=胃肠
LFT=肝功能检查
LOAEL=能观察到不良反应的最低水平
> 在考察的最高剂量,未见与毒理学有关的异常现象
() 临界效应,发生率和/或严重程度较低
a 剂量范围:0.1,1,2.5,5,25,125 mg/kg/天;暴露量数据来源于4周和6周试验,在雄性与雌性动物取均值
b 剂量范围:30,100,300 mg/kg/天
c 剂量范围:3,10,30,60mg/kg/天;暴露量数据来源于12个月试验,在雄性与雌性动物取均值
讨论和结论
Sorafenib的非临床安全性数据总结如下:
· 在多数应用高剂量的毒性试验中,系统暴露量低于随剂量成比例增长的水平,表明在各物种间进行比较时,以mg/m2体表面积来表示剂量可能比血药浓度更为合适。
· 对雄性和雌性动物的毒理学响应进行定性或定量分析,二者未见重要差异。
· 在大鼠,小鼠和犬,短期高剂量治疗在临床上有良好的耐受性。
· 与暴露量有关的发病率和死亡率(平均死亡时间≥3周)在大鼠和小鼠未见之前所述的物种间差异。在犬,胃肠毒性受到剂量的限制,除了皮肤反应和血样便之外,毒性临床指征并不明显。
· 未见本品对CNS功能产生相应作用。
· Sorafenib对心血管系统,尤其是对心脏复极化的影响似乎不可能在人体发生。
· 在动物试验中,血液学和血液临床化学常规参数的改变并非总是代表发生特异性器官损害。肝毒性标记物在血清中十分明显,但并未持续升高。
· 组织病理学观察发现,包括肝,肾,淋巴网状结缔/造血系统,胃肠道,胰腺,肾上腺,生殖器官,皮肤,牙齿和骨在内的多个器官系统发生退化和再生现象。在重复用药试验中,与毒理学有关的损害多数发生在接近或超过致死量的剂量水平。发生显著损害的阈剂量随暴露时间的延长而下降。大多数形态学损害完全可逆或至少趋向于恢复。在恢复期结束时,仅可见少数结构变化(如胆管增生,肝纤维化和对淋巴网状结缔组织的影响)。
· 在体外和体内遗传毒性试验中未见任何遗传毒性指征。
· 根据幼犬重复用药毒性试验结果,因本品可影响骨和牙齿的结构及组成,因此不能排除本品对儿童和青少年具有潜在危害。
· 重复用药一般毒性试验,胚胎-胎儿发育试验和组织分布试验结果表明,在人体,本品对生育以及孕期和哺乳期妇女具有一定危害。
在单独进行的毒理学试验中,人体内主要代谢产物和杂质对于整体毒理学资料来说无关紧要。
在动物亚慢性或长期服用Sorafenib(及相应的血药浓度)试验中观察到的多数毒性反应,与癌症患者服用推荐剂量每日两次,每次400mg后的结果相似。因此不能排除患者服用本品后的风险性;但是1300例以上的患者已经服用Sorafenib单一制剂,而且多数患者长期服用Sorafenib是安全的。
TAG: 多吉美
相关药品
电子药历跟踪
- 专科病种索引:
- 肿瘤科
- 肝病科
- 神经科
- 精神科
- 皮肤性病科
- 眼科
- 风湿免疫科
- 心脑血管科
- 糖尿病
- 泌尿生殖科
- 营养消化科
- 医疗器械科
- 药品说明书索引:
- 肿瘤科
- 肝病科
- 神经科
- 精神科
- 皮肤性病科
- 眼科
- 风湿免疫科
- 心脑血管科
- 糖尿病
- 泌尿生殖科
- 营养消化科
- 医疗器械科
- 佛山飞扬座厕椅FY696
- 康麦斯牌深海鱼油胶囊
- EW3108上臂式纤巧型电子血压计
- 鱼跃拐杖YU860(大)
- 汤臣倍健R小麦胚芽油软胶囊
- 邁克大夫 數位體溫計 MT 1671
- 欧得亿泰电动轮椅EW8603红色(配双电池)
- 信利红外线耳温计TET-350
- 欧得亿泰电动轮椅EW8605(配双电池)
- 拜耳血糖仪拜安易(促销套装)
- 百瑞康电动轮椅EW2000
- 登拐IT-304
- 汤臣倍健葡萄籽片(进口)
- YX302型指夹式脉搏血氧仪
- 鱼跃手杖YU822
- 康庄电子体温计TSO-A硬头
- 鱼跃臂式电子血压计YE660A
- 新华丰铝合金助行器HF7-09A
- 强生稳豪血糖仪
- 强生稳步型血糖试纸(50片)
- 汤臣倍健牌骨胶原高钙片
- 强生稳豪倍易型血糖仪(银色)
- 互邦铝合金坐便轮椅HBL9-B
- 盈拓活动扶手喷漆座厕凳IT806
- 华潮健康称98119
- 更多
- 药品专题索引:
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
- 暂无记录
- 暂无记录
- 暂无记录
- 暂无记录
网站资讯- 药房介绍 |
连锁门店分布 | 人才招聘 |
联系我们 | 网站地图
便民帮助- 常见问题 | 服务指南 | 药学服务 | 顾客意见 | 顾客投诉 | 专科服务 | 寻医问药 | 药师窗口
专科分类服务- 肿瘤科 | 肝病科 | 神经科 | 精神科 | 皮肤性病科 | 眼 科 | 风湿免疫科 | 心血管科 | 糖尿病科 | 其他科用药
药品导购服务- 肿瘤科药品 | 精神科药品 | 肝病科药品 | 眼科药品 |皮肤性病科药品 | 神经科药品 | 风湿免疫科药品
药房资质- 企业法人营业执照 | 药品经营许可证 | 药品经营质量管理规范认证 | 食品卫生许可证 | 互联网药品信息服务资格证
便民帮助- 常见问题 | 服务指南 | 药学服务 | 顾客意见 | 顾客投诉 | 专科服务 | 寻医问药 | 药师窗口
专科分类服务- 肿瘤科 | 肝病科 | 神经科 | 精神科 | 皮肤性病科 | 眼 科 | 风湿免疫科 | 心血管科 | 糖尿病科 | 其他科用药
药品导购服务- 肿瘤科药品 | 精神科药品 | 肝病科药品 | 眼科药品 |皮肤性病科药品 | 神经科药品 | 风湿免疫科药品
药房资质- 企业法人营业执照 | 药品经营许可证 | 药品经营质量管理规范认证 | 食品卫生许可证 | 互联网药品信息服务资格证









